Bộ Y tế yêu cầu Viện Kiểm định quốc gia văcxin và sinh phẩm y tế tăng cường giám sát định kỳ và đột xuất chất lượng, an toàn của văcxin để tiêm chủng.
Động thái trên được Bộ Y tế đưa ra sau 8 ca tai biến liên tiếp sau tiêm chủng văcxin 5 trong 1 Quivaxem tại Nghệ An, Bình Định, Hà Nội, Kiên Giang từ cuối năm ngoái đến đầu năm nay.
Để tăng cường công tác an toàn tiêm chủng Bộ trưởng Bộ Y tế Nguyễn Thị Kim Tiến yêu cầu Sở Y tế các tỉnh, thành chỉ đạo, tổ chức thực hiện tiêm chủng bảo đảm an toàn. Đồng thời tăng cường giám sát, phát hiện sớm và xử lý kịp thời các trường hợp phản ứng sau tiêm chủng, hạn chế tối đa tỷ lệ tử vong.
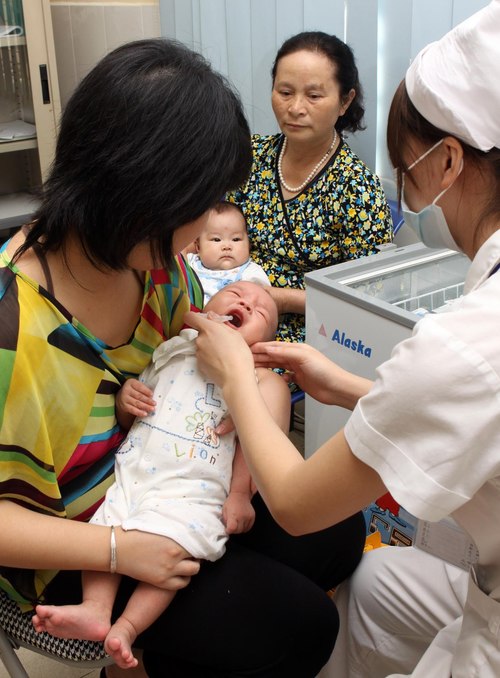
Tiêm chủng là cách an toàn và hiệu quả để bảo vệ trẻ trong những tháng đầu đời
Trung tâm Y tế dự phòng các địa phương tổ chức tập huấn, cấp chứng nhận thực hành tiêm chủng an toàn cho các cán bộ y tế. Bộ trưởng cũng yêu cầu Cục Quản lý Dược tăng cường quản lý chất lượng văxin, sinh phẩm y tế lưu hành tại Việt Nam. Thanh tra Bộ phối hợp với các đơn vị đẩy mạnh thanh, kiểm tra hoạt động tiêm chủng trong phạm vi cả nước.
Các cơ sở tiêm chủng có trách nhiệm tư vấn đầy đủ cho gia đình tác dụng, lợi ích và những rủi ro gặp phải khi tiêm chủng, khám sàng lọc để loại trừ những trường hợp chống chỉ định…
Những nghi vấn xung quanh văcxin 5 trong 1 Quinvaxem
Quinvaxem là văcxin ngừa cùng lúc 5 loại bệnh gồm bạch hầu, ho gà, uốn ván, Hib và viêm gan siêu vi do Hàn Quốc sản xuất. Năm 2006, Tổ chức Y tế Thế giới (WHO) chọn văcxin này để cung cấp cho chương trình tiêm chủng tại các nước đang phát triển.
Năm 2008 ít nhất 5 trẻ em ở Sri Lanka, 8 trẻ ở Bhutan và 3 trẻ ở Pakistan đã tử vong sau khi tiêm văcxin này. Hơn 34 triệu liều Quinvaxem đã được phân phối trên toàn thế giới vào thời điểm đó. Chính quyền Sri Lanka đã ngừng sử dụng văcxin trong năm 2008 sau 25 trường hợp phản ứng phụ nghiêm trọng. Bhutan cũng ngừng sử dụng nó trong vòng hai tháng sau khi văcxin này được đưa vào trong tháng 7/2009.
Sau một loạt tai biến, một nhóm chuyên gia của Tổ chức Y tế đã tiến hành điều tra và tuyên bố văcxin “không” gây ra những cái chết này. Sau đó, Sri Lanka tiếp tục sử dụng lại. Tuy nhiên, kết quả điều tra chưa tìm ra được nguyên nhân thực chất khiến những trẻ đó tử vong.
Năm 2010, văcxin này được giới thiệu tại Ấn Độ và ngay lập tức nhận phản đối của nhóm tư vấn tiêm chủng quốc gia của nước này, gồm các bác sĩ nhi khoa, giáo sư và các nhà hoạt động trong lĩnh vực y tế.
Tại Việt Nam văcxin được đưa vào chương trình tiêm chủng mở rộng từ tháng 6/2010. Theo thống kê, tỷ lệ gặp phản ứng nặng sau tiêm văcxin này là 0,69/1 triệu mũi tiêm, tỷ lệ tử vong là 0,17/1 triệu mũi. 3 lô văcxin mới bị tạm đình chỉ lưu hành vẫn đang trong quá trình kiểm nghiệm lại chất lượng.
Theo Bộ Y tế, các văcxin dùng trong tiêm chủng được phép lưu hành tại Việt Nam đều đạt yêu cầu về tính an toàn và công hiệu. Tuy nhiên trong quá trình sử dụng vẫn có thể xảy ra các trường hợp phản ứng sau tiêm.
Phương Trang
